花火を見ながら炎色反応について調べてみようと思って、まとめ記事を書いている。今回は電子殻と電子軌道についてまとめようと思う。
電子殻と電子軌道
電子殻については、高校化学でも習うことだろう。原子は電子と原子核からなり、原子核は中性子と陽子からなる。そして、電子が原子核の周りを一定の軌道(電子軌道)で回っており、電子軌道の集まりを電子殻と呼ぶ。電子殻は一番内側をK殻と呼び、そこから外側の電子殻は順番にL殻、M殻、N殻、・・・と呼ばれる。そして、電子殻に存在できる電子の数は内側のK殻から順に2, 8, 18, 32, ・・・と増えていき、一般に![]() 番目の殻には
番目の殻には![]() 個の電子が存在できる。
個の電子が存在できる。
もう少し詳しく電子殻について調べてみる。電子が一定の軌道で原子核の周りをまわるというのはどういうことだろうか。古典力学で考えれば、原子核と電子、電子同士のクーロン力と遠心力が釣り合っていれば、どんな軌道でも取りえると考えられる。また、電子のエネルギーは半径が小さいほど小さくなる。すると、電子はどんどんエネルギーの小さい、より安定するほうへと移動し、すなわち原子の半径がどんどん小さくなっていくと考えられる。ところが、現実の原子はある一定のサイズで安定している。すな条件がわち、何か電子に制限がかかっていると考えられる。ここで、ボーアは光のエネルギーが![]() の整数倍でなくてはならないということから、電子もプランク定数
の整数倍でなくてはならないということから、電子もプランク定数![]() に関係する制約があるのではないかと考え、ボーアの量子条件を導いた。
に関係する制約があるのではないかと考え、ボーアの量子条件を導いた。
![]()
この条件を満たすような半径だけを電子は取ることができるのである。このnは整数であるが、![]() がK殻、
がK殻、![]() がL殻と電子殻の番号に対応している。この
がL殻と電子殻の番号に対応している。この![]() を主量子数と呼ぶ。量子数には他に方位量子数と磁気量子数、スピン磁気量子数がある。詳細な説明は教科書や講義ノートなどの資料に譲るとして、簡単に説明すると、方位量子数は電子の軌道を決める定数、磁気量子数は軌道の方向を決める定数、スピン磁気量子数は電子のスピンの向きを決める定数である。方位量子数によって、その電子殻が
を主量子数と呼ぶ。量子数には他に方位量子数と磁気量子数、スピン磁気量子数がある。詳細な説明は教科書や講義ノートなどの資料に譲るとして、簡単に説明すると、方位量子数は電子の軌道を決める定数、磁気量子数は軌道の方向を決める定数、スピン磁気量子数は電子のスピンの向きを決める定数である。方位量子数によって、その電子殻が![]() 軌道、
軌道、![]() 軌道といった電子軌道を何種類持つかが決まり、磁気量子数によってそれぞれの軌道が何方向あるか決まる。また、主量子数
軌道といった電子軌道を何種類持つかが決まり、磁気量子数によってそれぞれの軌道が何方向あるか決まる。また、主量子数![]() 、方位量子数
、方位量子数![]() 、磁気量子数
、磁気量子数![]() には次のような関係がある。
には次のような関係がある。
![]()
![]()
の値をとることができる。例えば、![]() (K殻)であれば、
(K殻)であれば、![]() の一つしかなく、電子の軌道は
の一つしかなく、電子の軌道は![]() 軌道のみである。
軌道のみである。![]() なので、
なので、![]() 軌道と呼ぶ。一つの電子軌道にはスピン磁気量子数が異なる電子が二つ入ることができるので、K殻には2個の電子が入ることができる。
軌道と呼ぶ。一つの電子軌道にはスピン磁気量子数が異なる電子が二つ入ることができるので、K殻には2個の電子が入ることができる。
![]() (L殻)だと、
(L殻)だと、![]() の2つ軌道が存在し、
の2つ軌道が存在し、![]() に対しては
に対しては![]() の一方向、
の一方向、![]() に対しては
に対しては![]() の三方向ある。このことから、L殻の電子軌道は
の三方向ある。このことから、L殻の電子軌道は![]() 軌道(
軌道(![]() )と3つの
)と3つの![]() 軌道(
軌道(![]() )である。この
)である。この![]() 軌道は
軌道は![]() 軌道と呼ばれる。同様に一つの電子軌道に2個の電子が入ることができるので、L殻には8個の電子が入る。
軌道と呼ばれる。同様に一つの電子軌道に2個の電子が入ることができるので、L殻には8個の電子が入る。
これを一般化すると、![]() 番目の電子殻に存在することができる電子数は、
番目の電子殻に存在することができる電子数は、
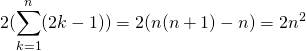
となる。少し解説すると、主量子数![]() の時、電子軌道は
の時、電子軌道は![]() 個存在できる。
個存在できる。![]() 個の電子軌道それぞれに
個の電子軌道それぞれに![]() 個の方向がある。それを足し合わせて、スピン2つ分で2倍することで、電子殻に存在することができる電子数を求めることができる。
個の方向がある。それを足し合わせて、スピン2つ分で2倍することで、電子殻に存在することができる電子数を求めることができる。
電子軌道のエネルギー
ここで、炎色反応に戻ろう。炎色反応で発光が起こる理由はエネルギーの高い電子軌道に電子が遷移し、それが元の軌道に戻るときに発光するからである。電子軌道のエネルギーは![]() の順にエネルギーが高くなり、この順に電子が配置されていく。
の順にエネルギーが高くなり、この順に電子が配置されていく。![]() と
と![]() が逆転している理由は、
が逆転している理由は、![]() 軌道は電子間相互作用の影響を大きく受けるため、電子軌道のエネルギーが
軌道は電子間相互作用の影響を大きく受けるため、電子軌道のエネルギーが![]() 軌道よりも大きくなってしまうのである。この各軌道のエネルギー差を各原子について調べることで、炎色反応が起こるかどうか(正確には可視光を発するかどうか)を知ることができる。
軌道よりも大きくなってしまうのである。この各軌道のエネルギー差を各原子について調べることで、炎色反応が起こるかどうか(正確には可視光を発するかどうか)を知ることができる。
まとめ
電子殻と電子軌道について高校化学から一歩進んだ内容までまとめた。もっと詳細は量子力学について調べてもらえるとありがたい。
特に量子力学の生まれるきっかけになった黒体放射について調べてみると面白いと思う。

最近のコメント